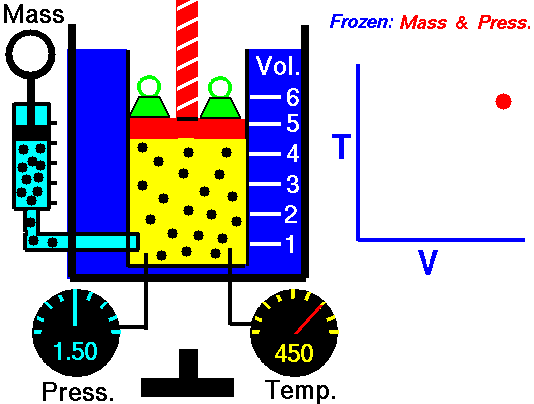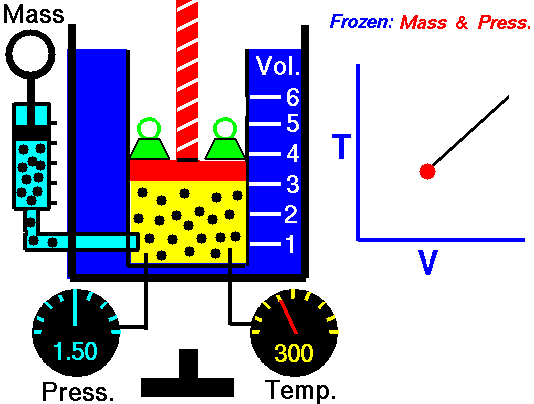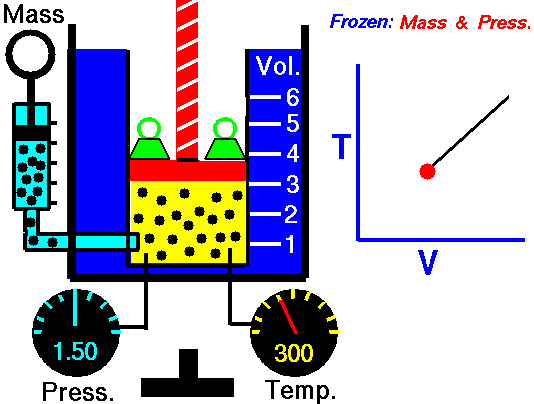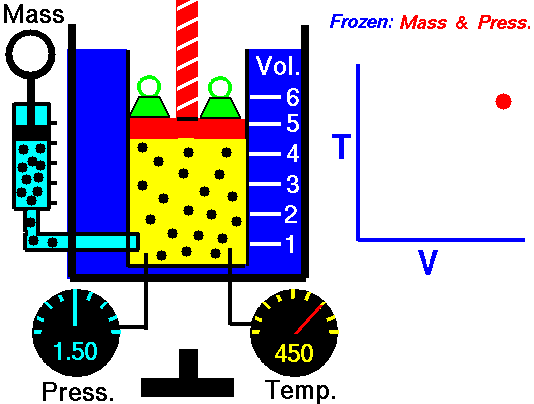
1˚ Ізотермічний процес.
Т = const, ΔT = 0
Р.Бойль (англ.), Е. Маріотт (фр.) , ХХVII ст.
Закон Бойля-Маріотта.
Добуток pV=const для даної кількості газу при постійній температурі.
Пояснення закону Бойля-Маріотта з точки зору МКТ.
Тиск – це узагальнена, усереднена дія молекул (атомів, частинок) на стінки. При зменшенні об’єму в декілька раз у стільки ж раз збільшується число молекул в одиниці об’єму (концентрація), а отже і число ударів молекул в стінки за одиницю часу. Останнє веде до зростання тиску.
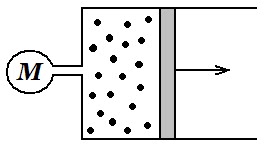 |
| Схема експерименту |
2˚Ізохоричний процес.
V = const, ΔV = 0
Ж. Шарль (фр.), 1787 рік.
Закон Шарля.
Тиск певної маси газу при нагріванні на 1˚С при постійному об’ємі збільшується на 1/273 частину його тиску при 0˚С.
р = р0(1 + αt)
де α =( p – p0)/p0t = 1/273 (K-1) - температурний коефіцієнт тиску.
Tt = T – 273; р = р0(1 + αt) = р0 + р0 α(T – 273) = p0αT.
Тому р = p0αT або р/Т = const при незмінній масі ідеального газу.
Пояснення закону Шарля на основі МКТ.
Згідно із основними положеннями МКТ при зростанні температури ідеального газу зростає середня швидкість руху молекул (атомів, частинок), а тому зростає частота стикання зі стінками посудини. Це зумовлює зростання тиску молекул на стінки.
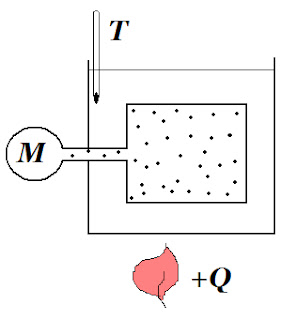 |
| Схема експерименту |
3˚ Ізобаричний процес.
р = const, Δр = 0
Ж. Гей-Люссак (фр.), 1802 рік.
Закон Гей-Люссака.
Збільшення температури газу на 1˚С при постійному тиску збільшує його об’єм на 1/273 частину того об’єму, котрий займає газ при 0˚С.
V = V0(1 + βt)
де β = (V – V0)/V0t – температурний коефіцієнт обємного розширення газу.
Враховуючи, що t = T – 273, закон Гей-Люссака можна подати у наступному вигляді:
V = V0βt, V/T = const, при незмінній масі ідеального газу.
Пояснення закону Гей-Люссака на основі МКТ.
Згідно із основними положеннями МКТ при зростанні температури ідеального газу зростає середня швидкість руху молекул (атомів, частинок), а тому зростає середня відстань між молекулами, що і зумовлює зростання об’єму, який займає ідеальний газ.
 |
| Схема експерименту |
Об’єднаний газовий закон.
Закони Бойля-Маріотта, Шарля та Гей-Люссака, які встановлені експериментально, об’єднуються в одну формулу, яку називають об’єднаним газовим законом.
Для даної маси ідеального газу (m = const) в ході довільного рівноважного термодинамічного процесу величина pV/T залишається постійною:
pV/T = const
Якщо у ході даного процесу маса газу змінюється, то об’єднаний газовий закон набуває наступного вигляду:
pV/(mT) = const
Рівняння стану.
Рівнянням стану ідеального газу називають співвідношення, яке пов’язує між собою параметри ідеального газу у рівноважному стані: f(p,V,T,m) = 0.
Експериментально встановлене рівняння
pV = (m/μ)RT
називають рівнянням стану або рівнянням Клапейрона-Менделєєва.
У останньому рівнянні R = 8,31 ДЖ/(моль•К) називають універсальною газовою постійною, а число ν = m/μ вказує на кількість молів речовини, для яких записано рівняння стану і корі перебувають у стані термодинамічної рівноваги.